硫酸和氢氧化钙反应的化学方程 硫酸和氢氧化钙反应的化学方程式
2023-08-18 18:36:16 来源: 互联网
1、H2SO4+2NaOH=Na2SO4+2H2O氢氧化钠和硫酸的反应属于酸碱中和反应定义:酸和碱作用生成盐和水的反应叫中和反应,是化学反应中复分解反应的一种。
2、2、实质:酸电离的氢离子和碱电离的氢氧根离子相互作用生成水的过程。
 (资料图)
(资料图)
3、3、应用:在实际生产生活中,人们常用中和反应改良土壤酸碱性、治疗胃酸过多、处理废水。
4、4、强调:中和反应都是放热反应。
5、酸、碱溶于水后在水中被电离成自由移动的阴离子和阳离子。
6、例如HCl(盐酸)被电离成氢离子(H+)和氯离子(Cl-),而NaOH(烧碱)被电离成钠离子(Na+)和氢氧根离子(OH-)。
7、氢离子和氢氧根离子结合成极难被电离的水,所以溶液中剩下的是钠离子和氯离子。
8、钠离子和氯离子在溶液中依然处于被电离的状态并不结合。
9、但是生成物是NaCl(盐)。
10、所以中和反应的实质就是酸与碱作用生成盐和水的反应。
11、中和反应反应特征在酸碱滴定中的理论值和实际值总有相差,当量点无法直接观察到,滴定时酸碱的强弱不同,达到滴定终点时溶液的酸碱性就不同,需选择适当指示剂使终点等于当量点,以作为判断标准。
12、指示剂的选择①强酸与强碱的中和滴定当量点溶液的pH=酸碱滴定中三个重要的点:(1)当量点:酸的当量数=碱的当量数(二者正好完全反应)(2)终点:指示剂变色的点.(3)中和点:酸碱滴定过程中,容易恰成中性的点. 即pH=7注意:当量点才是恰好完全反应的点,当量点不一定等于中性时,既可选酚酞做指示剂,也可选甲基橙做指示剂,一般不用紫色石蕊试液做指示剂,因其颜色突变不明显。
13、②强酸与弱碱的中和滴定当量点溶液显酸性,溶液pH<7,最好选甲基橙、甲基红做指示剂,一般不选酚酞试液做指示剂.因为酚酞溶液遇酸不变色。
14、③弱酸与强碱的中和滴定当量点溶液显碱性,pH>7,这时最好选酚酞做指示剂,一般不选甲基红和甲基橙做指示剂。
15、酸碱反应产生热量:强酸强碱反应,1mol氢离子与1mol氢氧根离子反应,△H=-57.3KJ。
本文到此分享完毕,希望对大家有所帮助。
热点推荐
-

工龄与退休后工资领取对照表 工龄30年能领多少退休金?
-
嘉凯城(000918.SZ)今日起临时停牌 复牌时间未知
-
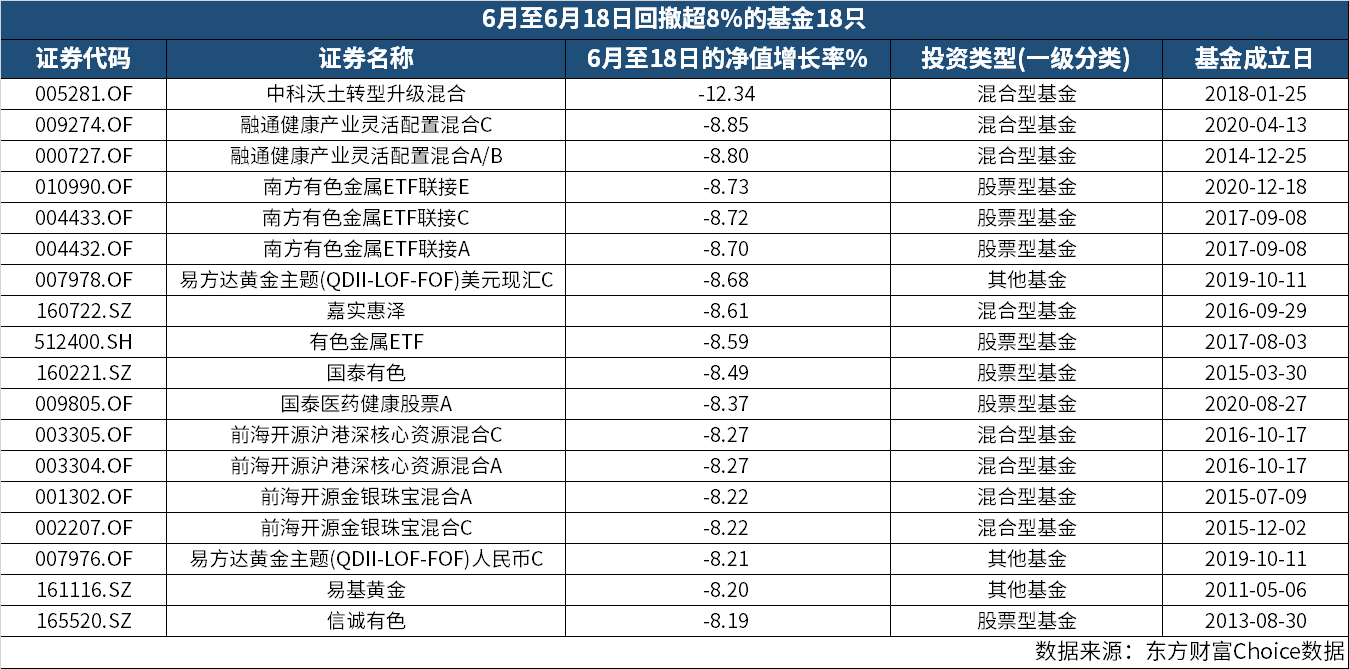
中科沃土转型升级混合 6月回撤已超12%
-
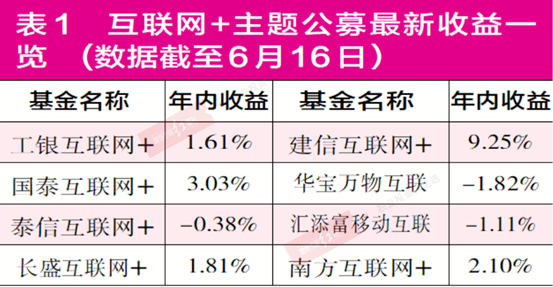
“互联网+”产品普遍举步维艰 多家产品被“深套”
-
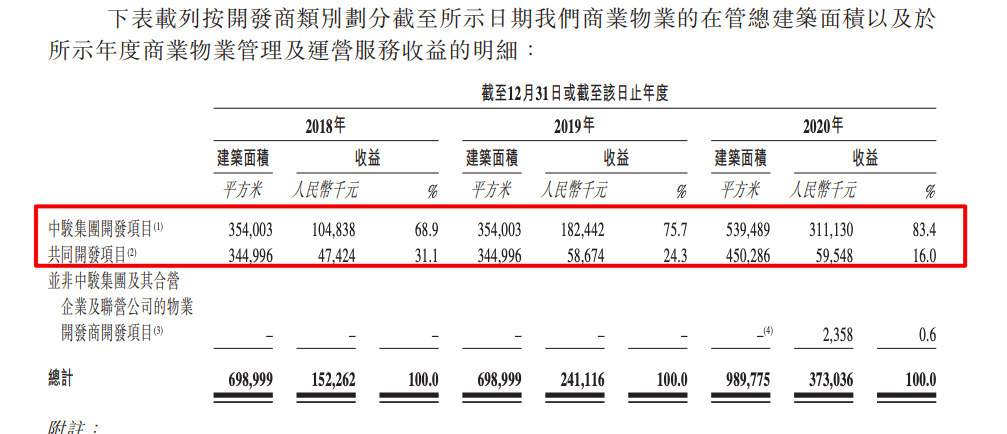
中骏商管将挂牌 中骏控股集团持股62.43%
-

硫酸和氢氧化钙反应的化学方程 硫酸和氢氧化钙反应的化学方程式
-

河北省农林科学院与张家口市农业科学院开展了对接帮扶活动
-

邵阳市十七届人大常委会第二十九次主任会议召开
-

从撒丁岛到阳明古镇:意大利大叔Nanni Corbia的中国情缘
-

群众文体活动热三晋
-

做好降雨防范应对!天津市防办最新通知
-

连续58天破亿元!你贡献了多少?
-

安卓版本9是什么意思(安卓9.0是什么意思)
-

中国概念股收盘:宜人金科、亚朵绩后涨逾5%,比特数字跌超12%
-

社会保险和商业保险有什么区别,商业保险作用有什么
-

环境监测数据造假花样繁多 遭生态环境部门严惩曝光
-

qq飞车改装最高多少_qq飞车改装
-

台州1号公路临海段今天正式开通
-

2023年聊城市“技能兴鲁”农机职业技能大赛举办
-

星网锐捷: 关于股东减资并完成工商变更登记的公告
-

招商蛇口&徐州产城竞得徐州云龙区1宗宅地 成交价17.1亿元
-

铝塑板密拼不留缝(地板砖不留缝会怎样)
-

府谷武家庄镇:生态宜居乡村靓 产业兴旺日子美
-

百联股份:董事谷峰辞任
-

美联储会议纪要:全球范围内的通胀有所回落
-

为他们筑起温暖的“家”,这个“清凉矩阵”服务点规模超370个
-

再降息!各方面压力都来了
-

“鮀岛号”顺利始发!国内首条客货共线铁路海底隧道进入盾构掘进阶段
-

2023天津西青区首届半程马拉松补给站在哪?
-

邦达亚洲:美联储会议纪要偏鹰 美元指数刷新6周高位